
研究概要
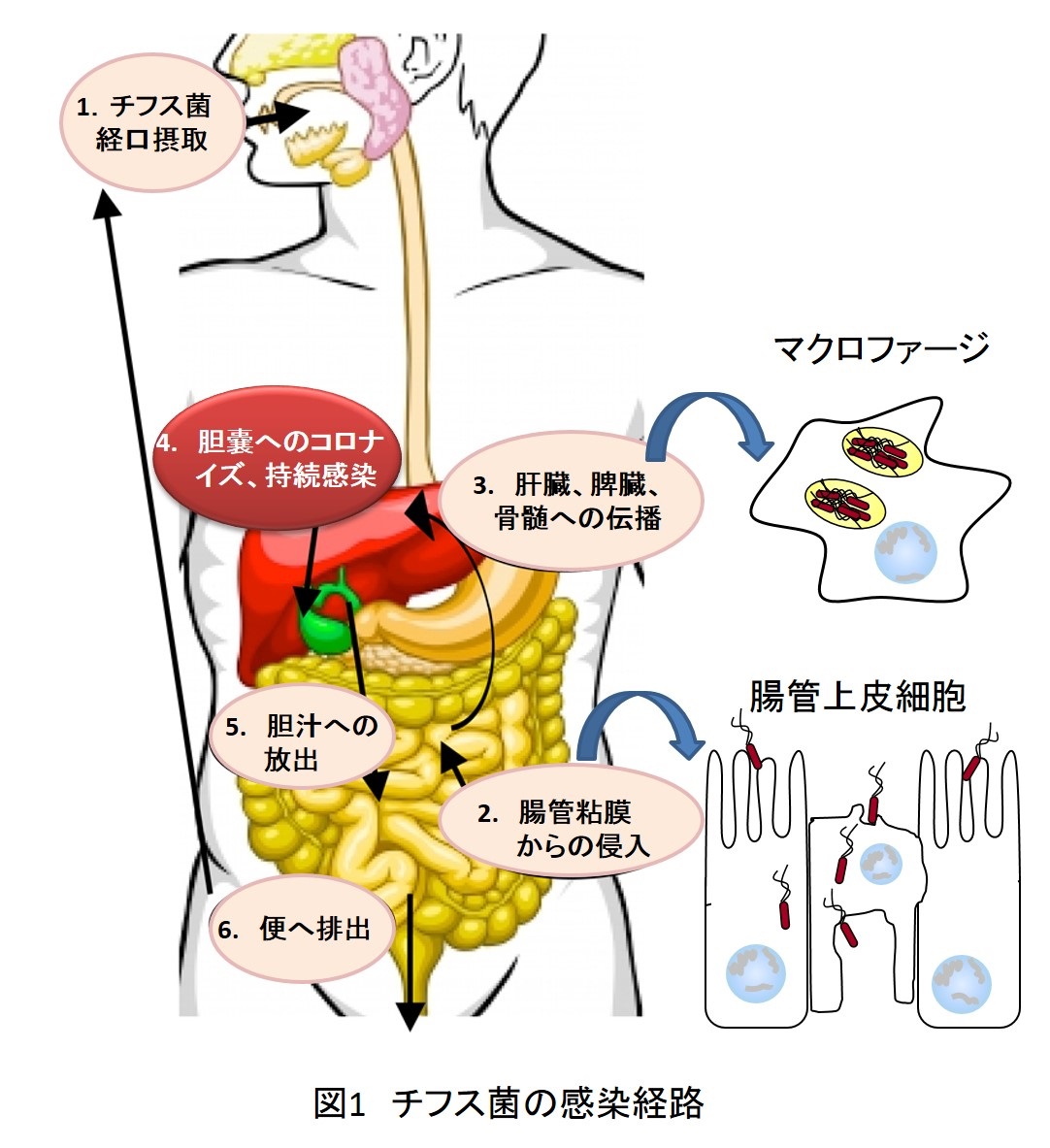
サルモネラ(Salmonella)感染症は、軽微な急性腸炎から重篤なチフス症まで多岐にわたる。世界保健機構によるとチフス菌(Salmonella enterica srovar Typhi)感染によるチフス症患者は世界で年間2200万人、そのうち死者は20万人と数えられている。一方非チフス性サルモネラ感染症(いわゆるサルモネラ食中毒)の患者数は年間1億3000万人にのぼるといわれ、わが国において最も注意すべき食中毒の一つである。
サルモネラは、経口感染して腸管に達した後、小腸粘膜上皮細胞やM細胞を使って組織に侵入する。腸管上皮細胞内に取り込まれた菌は炎症性サイトカインの産生を誘発して炎症を惹起する。その後、直下のマクロファージに貪食されるが、各種の殺菌機構に抵抗して食細胞内で一次増殖する。さらに増殖した菌がマクロファージに包まれたままリンパ管を経て血中に入り、肝臓や脾臓に伝播し、さらに組織のマクロファージ内で二次増殖して重篤な全身感染症を引き起こす(図1)。一方、感染者の1~4%では、免疫機構を回避して長期にわたり胆嚢に持続感染することがある。このようなチフス菌持続感染者(無症候キャリア)による周期的な排菌は、21世紀の今日においてもなおチフス症を克服できない大きな理由の一つとなっている。我々は、サルモネラによる全身感染症発症機構並びに持続感染機構の解明を目指して、分子レベルでの研究を行っている。serovar Typhiはヒト以外に感染しないことから、ヒトのチフス症によく似た全身感染症であるマウスのネズミチフス菌(serovar Typhimurium)感染症をチフス病態モデルとして用いている。
ストレス応答ネットワークによるサルモネラ病原遺伝子群の統合的発現制御機構の解明
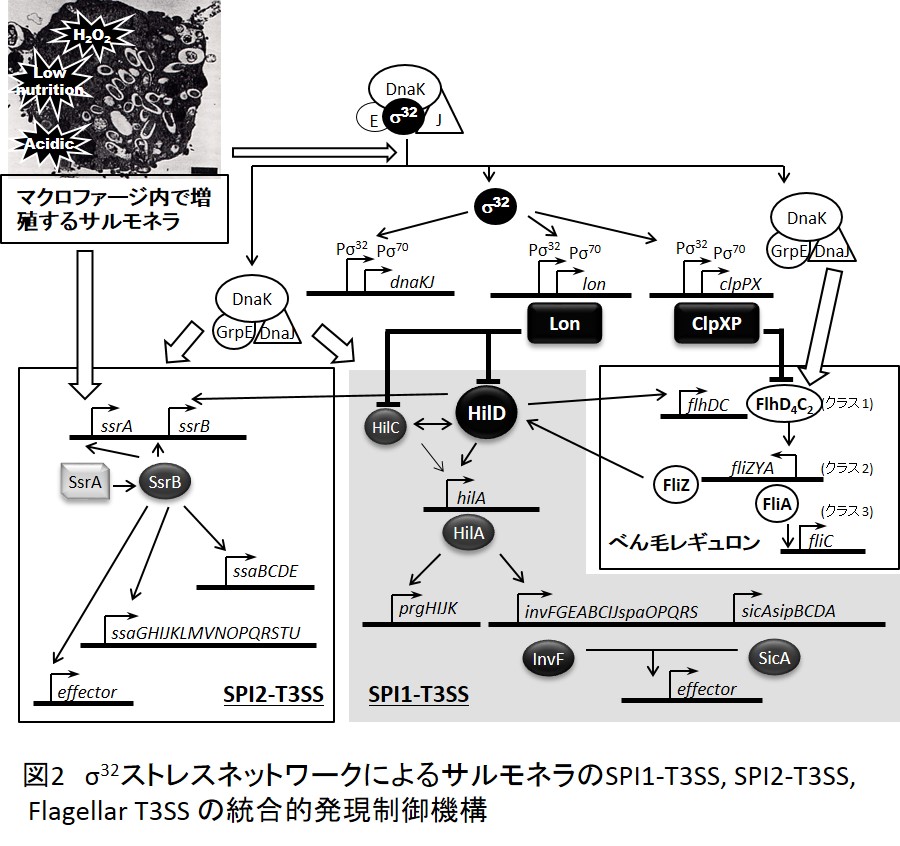
サルモネラの病原性に関わる因子は多種多様であり、ゲノム遺伝子の約4%にあたる200を超える病原遺伝子が存在すると考えられている。それらの多くはゲノム上のSalmonella Pathogenicity Island(SPI)と名付けられた大きな遺伝子の塊として存在し、これまでに10個のSPIが確認されている。それらの中で約40kbpの大きさを持つSPI1とSPI2は、タイプ3型蛋白質分泌装置(Type3 secretion system; T3SS)をコードしている。T3SSはニードル複合体ともよばれ、後述するように標的細胞に直接穴をあけ、病原機能蛋白質(エフェクター)を細菌細胞質から宿主細胞質へ輸送する蛋白質デリバリーシステムである。SPI1の機能は主に腸管上皮細胞への侵入や炎症惹起に、SPI2は主にマクロファージ内増殖に関与する。これらの病原遺伝子の発現は、感染の各段階で遭遇する環境の変化や生体防御機構の発動などに対して発現されるべく、高度な仕組みによって制御されている。我々は、かつて「病原細菌が、感染後に発動される生体側の防御機構に応答して、ストレスタンパク質とも称される分子シャペロンやプロテアーゼを誘発する」ことを見出し、これを契機に、「細菌病原戦略の発現は、感染宿主内で時間的・空間的に巧妙に制御されており、この制御にストレス応答により発現する分子シャペロンやプロテアーゼが重要な役割を果たす」ことを明らかにしてきた(図2)。これらの成果をさらに発展させ、ストレス応答ネットワークによるサルモネラ病原遺伝子群の統合的発現制御機構の解明を目指している。
病原分子(エフェクター)と宿主高次機能の相互作用に基づくサルモネラ全身機構の解明
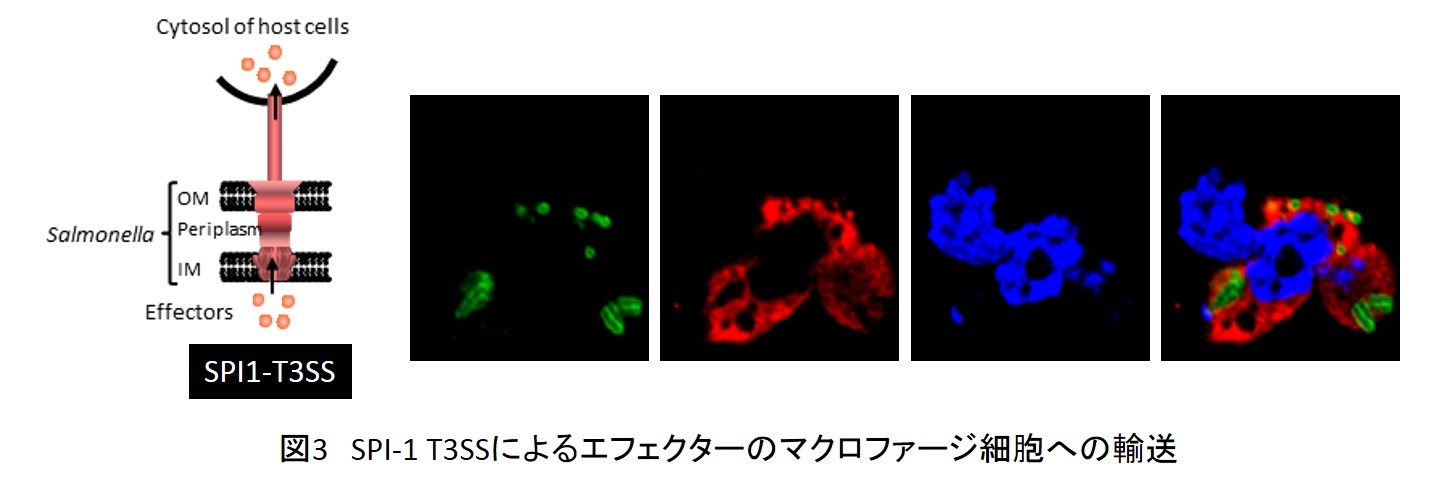
サルモネラをはじめ多くの病原細菌の病原戦略は、エフェクターと呼ばれる病原タンパクと宿主細胞標的分子間の相互作用を基盤としている。エフェクターは、進化した病原タンパク輸送装置[タイプ3型蛋白質分泌装置;Type3 secretion system(T3SS)](図3)によって感染の各段階で宿主細胞へ注入され、宿主細胞の高次機能をハイジャックあるいは破壊して、種々の感染現象を引き起こす。サルモネラは2組のT3SS (SPI1-T3SSとSPI2-T3SS)を持つが、SPI1-T3SSにより注入されたエフェクターの一部は、腸管粘膜上皮細胞への侵入、炎症反応の誘発や抑制、マクロファージや樹状細胞の細胞死誘導等に関わり、SPI2-T3SSにより輸送されたエフェクターの一部は、マクロファージ細胞内で菌を囲む膜胞(SCV)形成とその中での生存・増殖に必要な諸機能を司ることがあきらかにされつつある。これまでに遺伝子ランダム破壊法に基づいて多くのエフェクターが同定され、それらの機能が報告されてきたが、感染後に起こる宿主高次機能の多岐にわたる変化は未同定のエフェクターと未同定の標的分子が多数存在することを強く示唆していた。我々は、バイオインフォマティクスの手法により「in silicoインタラクトーム解析法」を開発して、多数の新規エフェクターの候補をリスト化した。新規エフェクターおよび機能未知の既知エフェクターのサルモネラ病原戦略上の機能解明を基盤としてサルモネラ全身感染症発症の分子機構解明にとりくんでいる。例えば、新規エフェクターの一つは、SPI1/SPI2両T3SSを使ってマクロファージに輸送され(図3)、Caspase-8活性化を介して感染宿主細胞の運命を決定するキーエフェクターであった。
感染宿主の免疫記憶形成を伴うサルモネラの持続感染機構の解明
チフス菌感染者の1~4%では、菌が免疫機構を回避して長期にわたり胆嚢に持続感染することがある。このようなチフス菌持続感染者(無症候キャリア)による周期的な排菌は、21世紀の今日においてもなおチフス症を克服できない大きな理由の一つとなっている。従ってチフス菌持続感染機構の解明は、地球上のチフス症を制御するために極めて重要な課題となるが、現在においても宿主との共生関係に立脚した持続感染機構は解明されていない。我々は前述のように、ストレス蛋白質によるサルモネラ病原性発現制御機構の研究を進めてきたが、その過程でストレス蛋白質Lon protease欠損株が長期にわたってマウスに持続感染することを見出した。免疫学研究者の強力な連携の下に、このLon protease欠損株持続感染マウスにおける記憶免疫細胞の解析を開始し、免疫記憶形成を伴うサルモネラ持続感染機構の解明に取り組んでいる。